
神経幹細胞からオリゴデンドロサイトが分化する時期と場所の特定
オリゴデンドロサイトは、大脳皮質の主要なグリア細胞の1つであり、神経軸索をミエリンと呼ばれる被覆で包み込むことにより、効率的な神経活動電位の伝達を達成しています。例えば多発性硬化症のように、ミエリンが破壊されて脱髄が起きると、脳や脊髄における神経活動が障害されて、運動麻痺や感覚障害、小脳失調などの症状が起きます。変性したオリゴデンドロサイトを復活させる再生医療が注目を集めていますが、内在性の神経幹細胞からオリゴデンドロサイトを分化させるためには、正常発生のメカニズムの理解が非常に重要なのです。
私たちは、胎仔期の脳において、神経幹細胞からオリゴデンドロサイトが分化するタイミングと場所を正確に特定することを試みました。その時期、その場所に存在する神経幹細胞を詳細に解析することで、オリゴデンドロサイト分化のメカニズムがより明らかになると考えたからです。
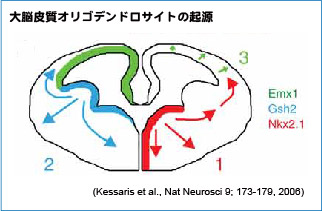
先行研究によって、オリゴデンドロサイトの発生
はSonic hedgehogと呼ばれる腹側から分泌される
因子の強い影響を受けることがわかっていましたが、
KessarisらはEmx1-Cre, Gsh2-Cre, Nkx2.1-Cre
マウスなどを駆使して、腹側由来のオリゴデンドロ
サイトは成体の大脳皮質にはほとんど観察されない
こと、背側(Emx1領域)由来のオリゴデンドロサ
イトが大多数を占めることを報告しました(右図)。
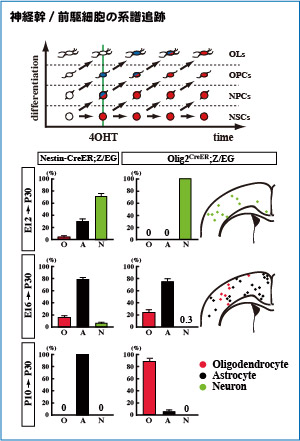
私たちの研究では、Nestin-CreERとOlig2-CreERという、2つのトランスジェニックマウスを用いることで、神経幹細胞からオリゴデンドロサイトが分化するタイミングを詳しく調べました。これらのマウスは、タモキシフェン (4OHT) を投与することで組換え酵素Creが働き、その時点でCreERを発現している細胞をGFPで永久標識することができます。
Nestin-CreERでは神経幹細胞 (NSCs) と、それよりやや分化しているが多分化能を保っている神経前駆細胞 (NPCs) を、Olig2-CreERでは神経前駆細胞とオリゴデンドロサイト前駆細胞 (OPCs) を、標識することができます。すなわち、自己複製している神経幹細胞はNestin-CreERでのみ標識されます。この差を利用して、最終的にオリゴデンドロサイト (OLs) になった細胞が、いつ分化を開始したのか見たところ、胎生16日から生後10日目の期間に限られることがわかりました。
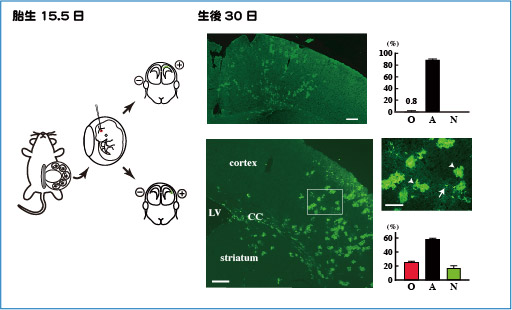
次に、オリゴデンドロサイトが産まれる場所の特定には、子宮内電気穿孔法を用いました(下図, 左)。これは子宮内の胎仔の脳にプラスミドを注入し、電気パルスを加えることで遺伝子を導入する方法です。
電気パルスのかけ方を工夫することで、任意の場所にGFP遺伝子を導入することができますが、背側(大脳皮質側)に打ち込んだときには、GFP陽性の神経前駆細胞はほとんどオリゴデンドロサイトに分化しませんでした(下図, 右上段)。
一方、背側と腹側の境界部にGFP遺伝子を導入したところ、20%強の細胞がオリゴデンドロサイトに分化していました(下図, 右下段. 矢印がオリゴデンドロサイトで、矢頭はアストロサイト)。ここでは示していませんが、内側の境界部からもオリゴデンドロサイトの分化が観察されたことから、境界部の神経幹細胞は特別な性質を持っている可能性が示唆されました。
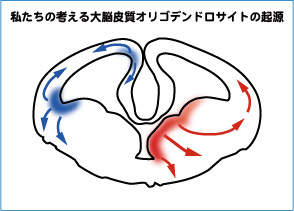
以上の結果から、私たちはオリゴデンドロサイト
の発生について、右図のようなモデルを考えていま
す。
背側の神経幹細胞は恐らくWntシグナルの影響で
オリゴデンドロサイトを産生することはできないが、
内外側の境界部からはWntによる抑制を乗り越えて、
オリゴデンドロサイトを産み出していると考えられ
ます。
今後、境界部でWntシグナルに拮抗するような因子や、境界部の神経幹細胞がもつ特別な性質を明らかにしていきたいと考えています。
本研究は、イギリスの神経科学専門誌Cerebral Cortex 2016年6月号に掲載されました。